El reciente debate sobre la posible legalización del consumo del Cannabis sativa, no solamente con fines terapéuticos, ha reactivado el interés en varios países por esta milenaria planta y su explotación industrial, medicinal y recreativa.
Sin embargo, cuando se habla sobre el cannabis, muy pocos recuerdan que su verdaderas o presuntas propiedades se deben a sus componentes químicos:
- sus fibras (que se componen de hidratos de carbono complejos y proteínas) para su uso en la industria textil y demás industrias tecnológicas;
- las proteínas y ácidos grasos (y también fibras) de sus semillas para su uso en alimentos y, posiblemente, en la industria nutracéutica; y
- para un uso recreativo y terapéutico de la flor del cannabis, una clase típica de compuestos de origen biosintético mixto, los cannabinoides.
De hecho, hay varias variedades de C. sativa con composiciones químicas diferentes que justifican sus diferentes usos. En consecuencia, cuando hablamos de la posibilidad de separar la actividad recreativa (es decir, la euforia y alteración de los estados de ánimo) de las preparaciones de cannabis de su posible actividad terapéutica (contra muchas afecciones desde la espasticidad, la inflamación, el dolor, convulsiones y enfermedades neurodegenerativas, el cáncer y el síndrome metabólico), con el fin de desarrollar con seguridad los tratamientos de esta planta, necesitamos entender cómo este tipo de cómo estas preparaciones difieren en sus composiciones de cannabinoides que ejercen efectos psicotrópicos y terapéuticos (es decir, Δ9tetrahidrocannabinol [THC]) o solamente lo segundo (por ejemplo, el cannabidiol [CBD]). Además, dado que los cannabinoides de todas las plantas se encuentran presentes en las flores del cannabis como precursores del ácido carboxílico, del que se producen tras la desecación o por la descarboxilación inducida por calor, incluso para una determinada variedad de cannabis, el tipo de cannabinoides que contiene depende del almacenamiento y tratamiento de la flor. Finalmente, los cannabinoides son compuestos lipofílicos (que no se disuelven fácilmente en el agua) y, por lo tanto, cualquier preparación de flores de cannabis que se desee utilizar con fines terapéuticos deberá tener en cuenta que las rutas de administración como infusiones orales no podrán proporcionar las cantidades de estos compuestos suficientes para producir el efecto deseado.
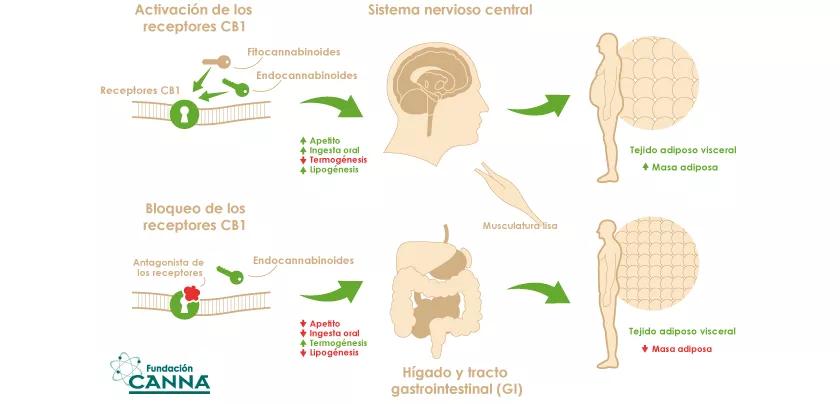
Este largo preámbulo tiene la intención de manifestar que la primera cosa que se debe recordar sobre el cannabis es que no existe "un solo tipo de cannabis" y, por lo tanto, cuando alguien pregunte: "¿Qué opina de la utilización terapéutica del cannabis?" la respuesta correcta es, por desgracia, otra serie de preguntas: "¿Qué tipo? Almacenados y administrados ¿cómo?". De hecho, creo que es mucho mejor hablar sobre el potencial de las acciones terapéuticas de los cannabinoides, de la misma forma en que también el profano ahora conoce las propiedades nutricionales de las semillas del cannabis, al igual que las de otros alimentos, debido a sus peculiares proteínas, fibras y ácidos grasos. ¿Qué sabemos acerca de los cannabinoides? Sabemos mucho acerca del THC, cuyos efectos farmacológicos sobre los mamíferos y los seres humanos son casi exclusivamente debidos a su capacidad de activación de dos receptores acoplados a la proteína G (GPCR) en la membrana externa de la célula, la de los receptores cannabinoides tipo 1 (CB1) y tipo 2 (CB2) (1). La euforia provocada por las propiedades del THC se debe al primero de estos dos receptores, y por lo tanto, cuando el receptor CB2 fue descubierto se creyó inmediatamente que podría dirigirse selectivamente mediante ligandos sintéticos que producirían una serie de efectos terapéuticos (contra, entre otros, varios trastornos inflamatorios y autoinmunes, el dolor, la fibrosis y la osteoporosis) sin los efectos psicotrópicos no deseados del THC (2). De hecho, está teniendo lugar una enorme actividad de desarrollo de este tipo de compuestos para la evaluación clínica, y como posibles sustitutos del THC (marinol, dronabinol) y sus derivados (por ejemplo, la nabilona). Ya estaba claro que no únicamente la actividad defectuosa de los receptores CB1 sino también la hiperactividad de este receptor podría ser la base de la enfermedad en modelos animales (por ejemplo, obesidad, hiperfagia y resarcimiento de adicciones, esquizofrenia, trastornos metabólicos y fibrosis hepatorenal y pulmonar) (3,4), se desarrollaron compuestos sintéticos antagonistas de la acción de los receptores CB1 y que han demostrado ser efectivos en ensayos clínicos contra la obesidad y la diabetes tipo 2 (4). Desafortunadamente, sin embargo y a diferencia de CB2, CB1 es muy abundante en las neuronas del cerebro de los mamíferos y, ahora se sabe que resulta muy importante para contrarrestar las consecuencias del estrés, la reducción crónica de la actividad de los receptores CB1 con antagonistas de los receptores CB1 mostró también signos de ansiedad, depresión e ideación suicida en algunos pacientes obesos, por lo que la evolución clínica de estos compuestos tuvo que ser interrumpida inmediatamente (4).
La presencia de receptores CB1 y CB2 en los mamíferos apuntó a la existencia de ligandos endógenos para estos receptores. Estos metabolitos, es decir, la anandamida y el 2-araquidonoilglicerol (2-AG), fueron descubiertos en la década de los años 90 (5,6) y pronto se denominaron endocannabinoides (7). Las enzimas responsables de su biosíntesis e inactivación fueron identificadas y caracterizadas entre el final del siglo pasado y el comienzo del actual (8-11). Estos descubrimientos y, la constatación de que las concentraciones tisulares de los endocannabinoides se alteran en los modelos animales de la mayoría de los trastornos durante las alteraciones fisiológicas (ciclos noche y día, privación de alimentos y re-alimentación a corto plazo, ciclo estral, estímulos estresantes a corto plazo a nivel celular y orgánico, etc.) o alteraciones patológicas de la homeostasis celular, llevaron a sugerir que el sistema endocannabinoide, es decir, el conjunto de los endocannabinoides, sus enzimas metabólicas y los receptores CB1 y CB2, se activan "a petición" de manera específica de célula y tiempo para intentar restablecer la homeostasis. Además, quedó claro que, exactamente igual que en los demás sistemas de señalización endógenos pro-homeostáticos (es decir, el sistema inmune), el sistema endocannabinoide puede llegar a ser desquiciado durante mucho tiempo por las perturbaciones de las células y de los órganos en estado estacionario, y por lo tanto, contribuye en ocasiones a los síntomas de la enfermedad o su desarrollo. Estas hipótesis han sido cada vez más confirmadas durante las dos últimas décadas, lo que conduce a la hipótesis de que los inhibidores de la biosíntesis o inactivación endocannabinoide podrían sustituir a la de los agonistas de los receptores CB1 (por ejemplo, el THC y sus análogos sintéticos) o antagonistas, respectivamente, como farmacoterapia más específica y, por lo tanto, más segura, ya que solamente actuarían "cuándo y dónde" se produzcan endocannabinoides para jugar una acción protectora o contraprotectora (12). Como consecuencia de ello, en los últimos 15 años se han hecho muchos esfuerzos para desarrollar clínicamente inhibidores seguros de la producción o degradación de la anandamida y el 2-AG (12). Esta estrategia, sin embargo, ha sido complicada por el hecho de que las vías biosintéticas y catabólicas de los endocannabinoides son redundantes y comparten con otros mediadores de lípidos bioactivos que no actúan sobre los receptores de cannabinoides pero tienen dianas moleculares que a menudo actúan de forma opuesta a los receptores CB1 y CB2. De hecho, ahora sabemos que probablemente existen cientos de tales mediadores del tipo endocannabinoide y que constituyen un verdadero "sistema endocannabinoide extendido" o endocannabinoidome (1). Por lo tanto, la inhibición de la inactivación endocannabinoide, por ejemplo, va a conducir a mejorar los niveles de las moléculas del tipo endocannabinoide y, posteriormente, a modular la actividad de las dianas para estas moléculas. Sin embargo, este hecho no debería desanimar a los desarrolladores de medicamentos a intentar orientar el sistema endocannabinoide hacia un uso terapéutico, ya que es posible, por ejemplo, desarrollar de forma racional inhibidores con dianas múltiples de biosíntesis endocannabinoide o degradadores de enzimas que, al mismo tiempo, bloqueen el efecto de los mediadores del tipo endocannabinoide en otras dianas (1).
Las recientes dificultades de desarrollo sintético de medicamentos basados en endocannabinoides coincidieron con un entusiasmo renovado hacia la explotación de los posibles efectos terapéuticos de los cannabinoides de plantas no sicotrópicas. De hecho, y, curiosamente, de los alrededor de 100 esos compuestos que se han encontrado hasta la fecha en las diversas variedades de C. sativa, solamente el THC es capaz de activar los receptores CB1 (y CB2) que, por cierto, en mi opinión deberían denominarse "receptores de THC" en lugar de "receptores de cannabinoides". También hay que considerar el hecho de que no se han encontrado hasta el momento otro tipo de cannabinoides que solamente actúe en un tipo de receptor específico que parece por el contrario estar modulando, no necesariamente con gran potencia, la actividad de cualquiera de los anteriormente conocidos o "nuevos" receptores huérfanos. En concreto, el CBD ha sido objeto de un número enorme de investigaciones farmacológicas que llevaron a identificar este compuesto en una docena de dianas moleculares, algunas de las cuales (como algunos canales receptores de potencial transitorio termosensitivos [PRT por sus siglas en inglés], receptores del proliferador activado de peroxisoma [PPAR por sus siglas en inglés] y GPCR huérfanos) son también receptoras de mediadores del tipo endocannabinoide, y por lo tanto, pertenecen al endocannabinoidome. Además, los estudios realizados en modelos experimentales, entre otros, (neuro)inflamatorios, enfermedades neurológicas, músculo esquelético, trastornos oncológicos y metabólicos, sugieren que el CBD, actuando simultáneamente en algunos de estas dianas, puede ser una valiosa herramienta terapéutica. También se creó la hipótesis de que el CBD, de nuevo gracias a su naturaleza de diana múltiple, podría "aminorar" algunos de los efectos centrales no deseados del THC, con lo que se ampliaría su estrecha ventana terapéutica (es decir, la diferencia entre la dosis seguras más eficaz y la más alta).
Esto llevó al desarrollo de Sativex, una combinación de dos extractos botánicos de dos variedades diferentes de C. sativa, una rica en THC y la otra en CBD que administra mediante un aerosol oromucosal una dosis aproximadamente igual de los dos cannabinoides. Este medicamento, primero en su categoría, se comercializa actualmente en más de 30 países contra la espasticidad y (solamente en Canadá) contra el dolor neuropático en pacientes con esclerosis múltiple (13). Más recientemente, el potencial terapéutico del CBD botánico per se contra los ataques en raras e incurables formas de epilepsia pediátrica también fue reconocido en varios ensayos clínicos y el compuesto fue posteriormente aprobado por la FDA para este uso como Epidiolex (14). Los resultados de otros ensayos clínicos con Sativex (en dolor crónico oncológico, glioblastoma y enfermedad de Huntington), el CBD (por ejemplo, en la dislipidemia diabética tipo 2 y la esquizofrenia) y Δ9-tetrahidrocannabivarina (THCV) (en la diabetes tipo 2) han dado resultados mixtos pero, no obstante, siempre prometedores y perfiles de seguridad no problemáticos.
En resumen, con el descubrimiento del sistema endocannabinoide en primer lugar y el endocannabinoidome posteriormente, además del "redescubrimiento" y desarrollo clínico de los de los cannabinoides botánicos, el largo camino para el diseño racional de nuevas terapias de C. sativafinalmente ha alcanzado su primer gran hito. Creo que, teniendo en cuenta sus posibles implicaciones clínicas, los éxitos obtenidos hasta ahora (en lugar de las decepciones a pesar de las muchas complicaciones y los retos que impone el complejo mundo de la bioquímica y la fisiología de los endocannabinoides y de la farmacología de los cannabinoides de la planta no psicoactivos [15]), son lo que realmente debería contar a la hora de decidir si debemos o no hacer esfuerzos adicionales para ampliar y mejorar el arsenal terapéutico generado a partir del estudio del cannabis y sus componentes.