La Comisión Interministerial de Precios de Medicamentos (CIMP) se ha negado a incluir en la Cartera de Servicios del Sistema Nacional de Salud el fármaco Spravato, un espray de pulverización a base de ketamina indicado contra la depresión severa resistente a tratamiento. El Spravato funciona en tan solo unas pocas horas y supone una revolución respecto a los fármacos antidepresivos disponibles hasta ahora. Las asociaciones de pacientes se han pronunciado contra la decisión del ministerio.
El Spravato fue aprobado por primera vez en 2019, tanto por la Administración de Fármacos estadounidense como por la Agencia Europea del Medicamento. Actualmente en Europa su uso está indicado en casos de depresión resistente a tratamiento (combinado con antidepresivos clásicos) y también en casos de emergencia psiquiátrica, como puede ser el riesgo de suicidio, en combinación con terapia antidepresiva oral. Desde el año pasado los sistemas de salud de Francia, Bélgica, Suecia, Alemania, Noruega, Dinamarca, Italia y Finlandia han aprobado su financiación.
Pero en España la Comisión de Precios de Medicamentos ha propuesto no financiar el Spravato aludiendo a “incertidumbres respecto a su valor terapéutico”, así como a la existencia de medicamentos u otras alternativas terapéuticas “a menor precio o inferior coste de tratamiento”. De este modo, la Comisión ha decidido rechazar el único fármaco aprobado en más de 30 años que ofrece una alternativa efectiva a los tratamientos tradicionales, que solo funcionan en el 14% de las personas con depresión resistente a tratamiento.

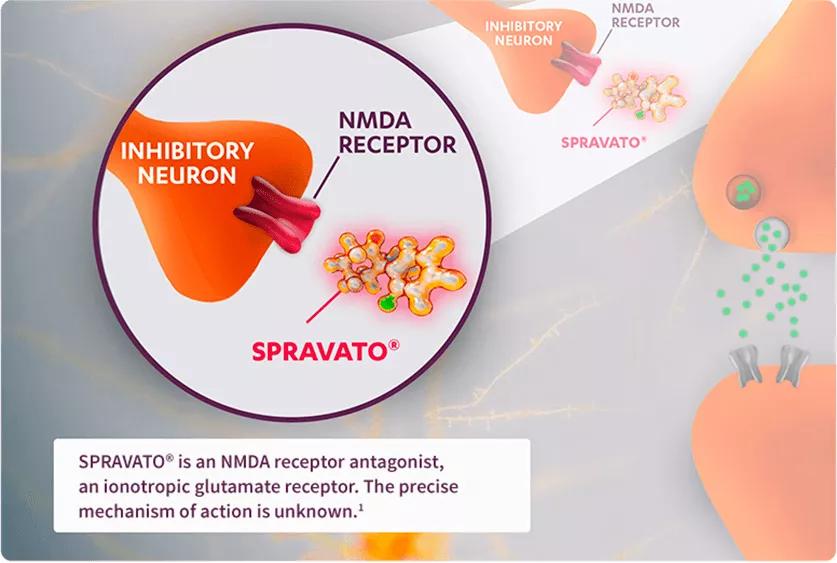
Una de las particularidades del Spravato es que, a diferencia de los antidepresivos clásicos, no necesita varias semanas para producir efectos. La ketamina del Spravato actúa sobre el sistema glutamatérgico, lo que lo convierte en un fármaco de acción rápida que produce efecto en pocas horas y resulta ideal para emergencias psiquiátricas y para combinar con los antidepresivos estándar, que actúan a partir de la cuarta semana de tratamiento.
“Tenemos una innovación real, que permite ver una mejoría en los pacientes en cuestión de horas y resulta que le damos la espalda”, declaró a La Razón Josep Antoni Ramos, jefe del servicio de Psiquiatría del Hospital Vall D’Hebrón, donde el fármaco se ha usado en estudios y pacientes con muy buenos resultados. “Hay evidencia suficiente sobre las grandes ventajas [...] Hacía muchísimos años que no teníamos, en el campo de la salud mental, una innovación que supusiera tal revolución en el mecanismo de acción y en los desafíos que cubre – rapidez de acción, tolerabilidad y eficacia – con respecto a las opciones disponibles fuera de indicación. Es una luz de esperanza que sin duda significa un antes y un después en el tratamiento de la depresión resistente a tratamiento”, explicó a La Razón.
La decisión de Sanidad ha generado quejas entre las asociación españolas de pacientes. “Consideramos que era un medicamento que tenía que financiarse, y confiábamos en que así se hiciera”, dijo Ana López, miembro de la junta directiva del Foro Español de Pacientes en el área de salud mental. “Es muy frustrante ver cómo se priva a personas que no tienen otra alternativa para acabar con su sufrimiento de un fármaco así, que supone un antes y un después en el abordaje de una patología tan incapacitante como es la depresión mayor, y solo por criterios económicos. Es realmente grave y, por ello, realmente esperamos que se rectifique”.